blanco
Tipos de sangre felina e isoeritrólisis neonatal
Los gatos tienen un sistema de grupos sanguíneos con tres tipos de sangre: tipo A, tipo B y tipo AB. Basándose en el hecho de que cada individuo tiene dos juegos de cromosomas, éstos se deben a diferentes formas (alelos) del mismo gen. Por lo tanto, sólo los gatos que lleven dos copias del alelo B (genotipo B/B homocigoto) tendrán el tipo de sangre B.
Los gatos con el tipo de sangre A pueden tener dos copias del alelo A (homocigoto AA) o una sola copia (heterocigoto A/B). El tipo A es completamente dominante sobre el tipo B. El tercer tipo de sangre, el tipo AB, parece ser una tercera forma del mismo gen, pero es raro. El tipo A es el más común de los grupos sanguíneos felinos, presente hasta en el 94%-99% de todos los gatos domésticos de pelo corto y largo en Estados Unidos.
La frecuencia de los grupos sanguíneos felinos varía tanto en función de la raza como de la ubicación dentro de Estados Unidos. La menor frecuencia de gatos de tipo B se da en las regiones del noreste y del centro-norte/montaña rocosa. Las frecuencias más altas de gatos de tipo B se encuentran en la Costa Oeste, alcanzando un máximo en el Noroeste con un 6% de gatos de tipo B.
Los gatos siameses y las razas relacionadas con la sangre oriental han demostrado hasta ahora tener sangre del tipo A. La raza americana de pelo corto, debido a su estrecho parentesco con los gatos de pelo corto no pedigüeños, también es mayoritariamente del tipo de sangre A. Sin embargo, algunas otras razas pueden tener un número asombrosamente alto de gatos del tipo B. La frecuencia de los tipos sanguíneos no varía geográficamente para los gatos de raza.
Frecuencia de los tipos de sangre en los gatos de raza
(De las encuestas realizadas por la Universidad de Pensilvania durante los últimos 15 años)
Raza % Tipo A % Tipo B
Abisinio 86 14
Americano de pelo corto 100 0
Birmano * 82 18
Británico de pelo corto * 64 36
Birmano 100 0
Cornish Rex 67 33
Devon Rex 59 41
Exótico de pelo corto 73 27
Himalayo 94 6
Bobtail japonés 84 16
Maine Coon 97 3
Gato de los Bosques de Noruega 93 7
Oriental de pelo corto 100 0
Persa 86 14
Azul ruso 100 0
Pliegue escocés * 81 19
Siamés 100 0
Somalí * 82 18
Sphynx * 83 17
Tonquinés 100 0
(* indica razas con algunos gatos de tipo AB)
Todos los gatos del tipo sanguíneo B tienen fuertes anticuerpos contra los del tipo A a partir de los tres meses de edad. Los gatos del tipo sanguíneo A suelen tener títulos de anticuerpos anti-B muy bajos. Es muy importante tener en cuenta que estos anticuerpos se producen de forma natural; a diferencia de otras especies, no es necesario un embarazo previo o una transfusión para el desarrollo de los anticuerpos.
Los fuertes anticuerpos anti-A en los gatos de tipo B son importantes en dos situaciones: las reacciones de transfusión de sangre tras la administración de sangre de tipo A a gatos de tipo B y la isoeritrólisis neonatal (NI o hemólisis del recién nacido) debido a que los eritrocitos de tipo A o AB de los recién nacidos son atacados por los anticuerpos anti-A del calostro de la madre de tipo B. No se ha demostrado que los anticuerpos anti-B causen IN, pero pueden provocar reacciones de transfusión si se administra sangre de tipo B a gatos de tipo A. Afortunadamente, estas situaciones pueden evitarse ahora.
La isoeritrólisis neonatal es un problema inmunológico y genético que se observa en los gatos, pero no en los perros. Puede ser responsable de una gran proporción de gatitos desvanecidos y de muertes neonatales en algunos criaderos de pedigrí, donde se desconoce el tipo de sangre de los gatos de cría. La NI se produce en gatitos del tipo de sangre A nacidos de una madre del tipo B apareada con un macho del tipo A. Si la gata es homocigota (A/A), todos los gatitos de la camada serán del tipo sanguíneo A y estarán en riesgo de padecer NI.
Si el macho es heterocigoto (A/B), entonces se espera que el 50% de la descendencia sea heterocigoto con el tipo de sangre A (genotipo A/B) y con riesgo de NI. Este problema también puede darse en gatitos de tipo AB nacidos de madres de tipo B.
Cuando los gatitos se amamantan de la madre después del nacimiento, reciben calostro que contiene anticuerpos para protegerlos contra las enfermedades infecciosas víricas comunes, pero también anticuerpos contra los tipos de sangre. El tracto digestivo del gatito es capaz de absorber estos anticuerpos, que pasan al torrente sanguíneo,durante las primeras 12-24 horas de vida.
Después de ese tiempo, se produce un «cierre intestinal» en el neonato que impide la absorción de cualquier anticuerpo. Cuando los gatitos de tipo A o AB amamantan a una reina de tipo B durante el primer día de vida, reciben anticuerpos anti-A en el calostro, que a su vez pasan al torrente sanguíneo y se unen a sus glóbulos rojos y los destruyen (lo que se conoce como isoeritrólisis).
Los signos clínicos de la IN son variables. Las grandes variaciones en los signos clínicos pueden deberse a la ingestión de distintos grados de anticuerpos anti-A en el calostro o a factores aún no determinados. Normalmente, los gatitos nacen sanos y amamantan bien. Los signos clínicos pueden aparecer rápidamente, y algunos gatitos mueren repentinamente, en cuestión de horas.
Otros gatitos dejarán de ser amamantados en los tres primeros días de vida con signos sugestivos de falta de crecimiento, orina de color rojo-marrón, ictericia y anemia. A medida que se deterioran, pueden aparecer letargo, debilidad, respiración acelerada, ritmo cardíaco muy lento o rápido, así como colapso y, finalmente, la muerte.
Algunos gatitos parecen tener una enfermedad subclínica sin signos clínicos evidentes. Sin embargo, si se analizan, pueden tener anemia. Los gatitos que sobreviven pueden desarrollar daños en la piel de la punta de la cola hasta dos semanas después.
Los gatitos con signos de NI deben ser retirados inmediatamente de la madre para evitar una mayor absorción de anticuerpos. Sólo es necesario separarlos de la madre durante las primeras 24 horas de vida, ya que después no se absorben anticuerpos. Los gatitos deben ser amamantados por una madre con sangre del tipo A, si está disponible, o alimentados a mano con un sustituto de leche para gatitos. Los gatitos con anemia severa requieren una transfusión, pero desafortunadamente estos esfuerzos rara vez tienen éxito.
Dado que la tasa de mortalidad con NI es alta, la situación predisponente debería prevenirse conociendo el tipo de sangre de los gatos reproductores en razas con ocurrencias conocidas de sangre tipo B. En las razas con bajas frecuencias de sangre tipo B y en los criaderos con mayoría de gatos tipo A, los gatos que son del tipo de sangre B no pueden ser utilizados para la cría, con el fin de minimizar los futuros problemas de NI.
Muchos criadores están registrando ahora el tipo de sangre de cada gato en las tablas de pedigrí para facilitar las decisiones de cría. La determinación del grupo sanguíneo puede hacerse en un laboratorio de referencia o utilizando tarjetas de determinación del grupo sanguíneo en la clínica.
Cuando hay que realizar un cruce entre una madre de tipo B y un gato de tipo A, el criador debe procurar estar presente en el nacimiento de los gatitos para evitar la lactancia de la madre. El método más fácil es cruzar una segunda madre con sangre de tipo A un poco antes, para que las camadas de las 2 madres puedan ser intercambiadas.
La camada de la segunda madre debe tener más de 24 horas para poder intercambiar camadas. Esto tiene la ventaja adicional de permitir que los gatitos adquieran cierta inmunidad pasiva de la leche de la madre de acogida. La leche de la madre contiene cantidades similares de anticuerpos que el calostro. La otra opción es alimentar a los gatitos a mano con un sustituto de leche comercial.
La experiencia sugiere que estos gatitos estarán bien, aunque no tendrán anticuerpos protectores. En cualquiera de los dos casos, los gatitos pueden ser devueltos a su propia madre en 24 horas. Algunos criadores que optan por la alimentación manual con sustituto de leche permiten que los gatitos permanezcan con la madre para su cuidado, pero dotan a la madre de un tipo de media corporal para que los gatitos no puedan amamantarse.
Sin embargo, hay algunos neonatos astutos que siguen encontrando el camino hacia los pezones y sufren las consecuencias.
Pediatría felina: Cómo tratar a los pequeños y a los gatitos enfermos
A la mayoría de los veterinarios se les han presentado gatitos que no han prosperado. Estos pacientes son un reto debido a su pequeño tamaño, su fisiología desconocida y la tendencia a que su estado se deteriore rápidamente. Las causas generales más comunes de la enfermedad y el retraso en el desarrollo son factores maternos, gestuales, ambientales, genéticos e infecciosos.
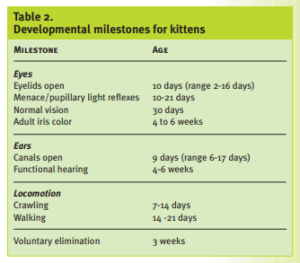
En gran parte de la literatura veterinaria, el periodo neonatal se define como las primeras 4 semanas de vida. Sin embargo, desde el punto de vista clínico es útil considerar períodos de riesgo definidos: los primeros 4 días de vida (cuando muchos problemas están relacionados con el parto o el entorno); entre los 21 y 28 días de edad (cuando se producen cambios importantes que conducen a la maduración neurológica y conductual); y el destete (de 4 a 6 semanas de edad).
Examen de los gatitos neonatos
Hay muchas diferencias fisiológicas clínicamente relevantes entre los gatitos neonatos y los gatos adultos , y los gatitos muy jóvenes no pueden ser abordados como pequeños adultos. Los neonatos enfermos deben ser examinados lo antes posible, utilizando un enfoque sistemático que incluya una historia completa del gatito, la camada y la madre; el examen del gatito y la madre; y las pruebas de diagnóstico. Los gatitos de menos de 4 semanas deben ser examinados con la madre presente, siempre que sea posible.
Comience con un historial médico completo del gatito en cuestión, así como de sus compañeros de camada. También puede ser útil tener un historial médico de la madre, si está disponible (por ejemplo, enfermedad, nutrición, vacunas), e información sobre el parto y el nacimiento, especialmente para los gatitos de menos de 2 semanas.
Si no es la primera camada de la madre, también debe recopilarse información sobre las camadas anteriores y cualquier problema previo con el parto. Investigar el entorno del hogar del gatito, observando la temperatura y la humedad, el saneamiento, la ventilación, la densidad de población, la presencia de otros animales domésticos y niños pequeños, y la prevalencia de enfermedades infecciosas y parásitos.
Los neonatos deben manipularse con cuidado, sobre una superficie limpia y caliente. Hay que lavarse las manos y usar guantes. Para las exploraciones neonatales bastará con un equipo sencillo: una báscula de gramos, un termómetro rectal pediátrico, un otoscopio con conos para bebés, una linterna y un estetoscopio con campana y diafragma para bebés.
Antes de manipular al gatito, observe su estado corporal y su respuesta al entorno, incluyendo el estado de alerta, la postura, el movimiento loco y la frecuencia y el carácter respiratorio. Los neonatos sanos tienen un fuerte reflejo de succión que, en comparación, es normalmente menos fuerte que el de un cachorro sano.
La temperatura corporal normal de los gatitos neonatos es de 36°C a 37°C (97°F a 98°F). La temperatura rectal aumenta lentamente, alcanzando los 38°C (100°F) hacia las 4 semanas de edad. Durante las dos primeras semanas de vida, los gatitos son esencialmente poiquilotérmicos y carecen de reflejo de escalofrío. Se vuelven gradualmente homeotérmicos después de los 14 días de edad, pero siguen siendo susceptibles a las condiciones ambientales y pueden volverse hipotérmicos fácilmente.
Parámetros Valores normales :
- Peso al nacer 90-110 g (0,09-0,11 kg)Temperatura rectal: recién nacido 97°F-98°F (36°C-37°C)
- Temperatura rectal: 1 mes 100°F (38°C)
- Frecuencia cardiaca 220-260 lpm durante las dos primeras semanas de vida
- Frecuencia respiratoria: recién nacido 10-18 respiraciones/min.
- Frecuencia respiratoria: 1 semana 15-35 respiraciones/min
- Gravedad específica de la orina <1,020 Producción de orina 25 mL/kg/d Necesidad de agua 130-220 mL/kg/d
- Necesidades calóricas 20 kcal EM/100 g/d Capacidad del estómago 4-5 mL/100 g
EM = energía metabolizable.
Si se desconoce la fecha de nacimiento, intente establecer una edad estimada para el gatito utilizando el peso corporal y la inspección de la dentición.
El peso típico de un gatito al nacer es de 90 a 110 g (rango: 80 gatitos y puede causar una pérdida significativa de líquidos. La hematuria o la pigmenturia pueden ser signos de infección del tracto urinario, traumatismo o isoeritrolisis neonatal.
Los gatitos normales ganan de 50 a 100 g/semana (10 a 15 g/d) y deberían duplicar su peso al nacer antes de las 2 semanas de edad. El bajo peso al nacer es una causa común de mortalidad, siendo los gatitos que pesan menos de 75 g al nacer los que corren mayor riesgo.
Los primeros dientes de leche que aparecen son los incisivos y los caninos a las 3 ó 4 semanas de edad. Los premolares erupcionan a las 5 ó 6 semanas de edad. La fórmula dental de los dientes de leche es 2 (I3/3, C1/1, P3/2) = 26; no hay molares de leche. Los hitos del desarrollo también pueden ser útiles para estimar la edad, aunque puede producirse un retraso en el desarrollo de los gatitos con bajo peso al nacer y poco aumento de peso.
Algunos ejemplos son la marcha descoordinada a los 21 días y la marcha coordinada a los 28 días.
Inspeccione al neonato en busca de anomalías anatómicas graves, como paladar o labio leporino, hernia umbilical o infección, fontanela abierta, deformidades de las extremidades, deformidades de la pared torácica y aberturas urogenitales o rectales no patentes.
Los gatitos de menos de tres semanas no pueden eliminar la orina y las heces de forma voluntaria. Evalúe los reflejos de micción y defecación de un gatito utilizando una bola de algodón humedecida con aceite mineral o agua caliente para estimular la zona anogenital.
La diarrea está presente en aproximadamente el 60% de los gatitos neonatales enfermos y puede causar una pérdida de líquidos importante. La hematuria o la pigmenturia pueden ser signos de infección del tracto urinario, traumatismo o isoeritrólisis neonatal.
La isoeritrólisis neonatal puede ser un problema común en algunas razas (por ejemplo, British shorthair, Cornish rex, Devon rex) con un alto porcentaje de individuos con el tipo de sangre B.
Los ojos deben inspeccionarse en busca de anomalías del globo o párpados y si hay oftalmia neonatal (antes de que se abran los ojos) o conjuntivitis (después de que se abran los ojos). El reflejo de amenaza y las respuestas pupilares de la luz no aparecen hasta los 28 días de edad o más tarde.
El estrabismo divergente puede estar presente y es normal hasta aproximadamente 8 semanas de edad, a menos que haya hidrocefalia. La evaluación del fondo de ojo es difícil hasta las 6 semanas de edad.
Los pabellones auriculares deben inspeccionarse en busca de evidencias de traumatismos, parásitos como los ácaros del oído y enfermedades de la piel.Los conductos auditivos no son fáciles .
Cómo tratar a los pequeños y a los enfermos.
Inspeccione con un otoscopio hasta después de las 4 semanas de edad. El pelaje del neonato debe estar limpio y brillante. Los gatitos neonatos sanos pueden tener las mucosas algo hiperémicas hasta los 7 días de edad (aunque la hiperemia también puede ser un signo de deshidratación), mientras que los neonatos enfermos suelen tener las mucosas pálidas, grises o cianóticas. Los gatitos con las mucosas cianóticas tienen un mal pronóstico.
El sistema cardiovascular experimenta cambios drásticos a medida que el corazón asume las funciones que antes realizaba la circulación feto-materna. Una diferencia fisiológica importante entre los neonatos y los adultos es la mayor frecuencia cardíaca neonatal. La frecuencia cardíaca neonatal normal puede ser superior a 200 lpm (rango: 220 a 260 lpm).
La frecuencia respiratoria normal es de 15 a 35 respiraciones/min. Los soplos funcionales pueden estar presentes en los neonatos debido a anemia, hipoproteinemia, fiebre o sepsis. Los soplos inocentes no asociados a enfermedad son más frecuentes en los cachorros que en los gatitos; deben investigarse los soplos presentes después de los 4 meses de edad. Las cardiopatías congénitas pueden estar asociadas a soplos fuertes y
acompañados de un estremecimiento precordial. Las cardiopatías congénitas más comunes en los gatitos son la displasia de la válvula tricúspide y la comunicación interventricular.
La palpación abdominal puede realizarse con cuidado; en los primeros días de vida, la presión abdominal durante la palpación puede inducir la regurgitación del contenido del estómago y la aspiración. Un abdomen lleno es normal en un gatito bien alimentado, pero un abdomen agrandado en un gatito enfermo puede indicar aerofagia. El hígado y el bazo normales pueden no ser palpables; los riñones son frecuentemente palpables. El estómago puede ser palpable si está lleno. El tracto intestinal es palpable como asas intestinales
fluidas que deben moverse libremente y no son dolorosas.
La vejiga urinaria normal también es palpable, móvil y no dolorosa.
Diagnóstico
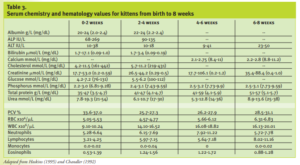
Para la venopunción, coloque al gatito en decúbito dorsal con las patas delanteras hacia el abdomen y la cabeza y el cuello extendidos. Extraer la sangre de la vena yugular con una jeringa de 1 mL con una aguja de calibre 25 ó 26. La aspiración lenta de la sangre es esencial para evitar el colapso de la vena. Se puede utilizar un pequeño volumen (0,5 mL) de sangre para las pruebas más críticas .Los valores de química sanguínea y hematología de los neonatos difieren de los de los adultos ; la mayoría de los valores se normalizan a los niveles de los adultos a los 4 meses de edad.8 -La orina se recoge para el análisis químico, del sedimento y de la gravedad específica mediante la estimulación del perineo; la cistocentesis debe realizarse con mucho cuidado en los más pequeños porque la pared de la vejiga se daña con facilidad y porque la vasculatura umbilical puede ser todavía patente y puede estar traumatizada.
La gravedad específica de la orina es de 1,020 o menos en las primeras semanas de vida; los valores adultos se alcanzan alrededor de las 8 semanas de edad.11 Debe examinarse una muestra fecal para detectar parásitos intestinales comunes como Giardia e Isospora spp y lombrices redondas mediante centrifugación con sulfato de zinc, un frotis salino directo y una prueba de antígeno fecal de Giardia. Los gatitos de tan sólo 2 semanas pueden ser tratados con pamoato de pirantel (5 a 10 mg/kg PO cada 2 semanas).
Las infestaciones por pulgas deben tratarse de forma agresiva, ya que pueden causar una anemia potencialmente mortal. Los gatitos jóvenes pueden ser bañados con un champú apto para mascotas, seguido de un secado exhaustivo y un peinado del pelaje. También pueden utilizarse sprays de piretrina a base de agua etiquetados para su uso en gatitos. Nitenpyram está etiquetado para su uso en gatitos de al menos 4 semanas de edad y con un peso mínimo de 0,9 kg. La mayoría de los demás productos antipulgas están indicados para su uso en gatitos a partir de las 8 semanas.
Aunque, anecdóticamente, la selamectina se ha utilizado en gatitos de tan sólo 6 semanas de edad. Las infestaciones por ácaros del oído (Otodectes) se tratan mejor con ivermectina tópica. Un producto (Acarexx, Boehringer Ingelheim) ha demostrado ser seguro en gatitos de tan sólo 4 semanas de edad.
Las pruebas de detección de FeLV y FIV son una parte importante tanto del cuidado del bienestar como de la investigación de enfermedades . Las recomendaciones para las pruebas de FeLV y FIV en gatitos han sido publicadas recientemente y deberían ser revisadas.
La necropsia está infrautilizada como herramienta de diagnóstico en entornos de varios gatos, como refugios o criaderos. Los resultados de la necropsia pueden proporcionar la información necesaria para salvar a los compañeros de camada restantes o a una futura camada. Para obtener los mejores resultados, el cuerpo entero debe ser enviado (refrigerado, no congelado) a un patólogo cualificado. Si es necesario, la congelación es preferible a la autolisis.
Terapéutica básica
La rápida identificación de la enfermedad y la rápida intervención son las claves del éxito en el tratamiento de los gatitos enfermos. A menudo, la causa exacta de la enfermedad de un gatito no es evidente en el momento de la presentación, y la terapia debe centrarse en los cuidados de apoyo. El tratamiento inicial puede incluir calor suplementario, hidratación, administración de glucosa y apoyo nutricional. Es importante conocer las diferencias fisiológicas entre los gatos neonatos y los adultos, y debe revisarse la información sobre estas diferencias.
La hipotermia grave se produce cuando la temperatura rectal del gatito es inferior a 34,4 ºC y se asocia con una respiración deprimida, un deterioro de la función del sistema inmunitario, bradicardia e íleo. Los gatitos hipotérmicos deben ser recalentados lentamente, a lo largo de 2 a 3 horas o más, hasta alcanzar una temperatura rectal máxima adecuada a su edad.
Un calentamiento demasiado rápido puede provocar un aumento de la demanda metabólica, lo que puede causar deshidratación, hipoxia y pérdida de la integridad cardiovascular. Una incubadora o una jaula de oxígeno es una buena forma de lograr el recalentamiento, pero también pueden utilizarse bolsas de agua caliente y lámparas de calor con una supervisión muy cuidadosa.
En el caso de los gatitos con hipotermia grave, pueden administrarse líquidos calentados a 35°C-37°C por vía intravenosa o intraósea (dependiendo de la edad). Nunca intente alimentar a un gatito hipotérmico, ya que la neumonía por aspiración debida a la hipomotilidad gastrointestinal y la regurgitación es un riesgo importante. La hipoglucemia clínica se produce cuando el nivel de glucosa en sangre es <3 mmol/L (50 mg/dL) y es un problema común para los neonatos enfermos debido a la inmadurez de la función hepática de los gatitos y al rápido agotamiento de las reservas de glucógeno. La hipoglucemia puede estar causada por vómitos, diarrea, sepsis, hipotermia o una ingesta nutricional inadecuada.
Los gatitos con hipoglucemia estarán débiles y letárgicos y pueden estar anoréxicos. Si el gatito no está hipotérmico o deshidratado, administre periódicamente dextrosa al 5% o al 10% por vía oral mediante una sonda gástrica a razón de 0,25 a 0,50 mL/100 g de peso corporal hasta que el gatito esté más fuerte y sea normoglucémico.
A continuación, comience a alimentar a los gatitos con un sustituto de la leche si no se dispone de una reina adoptiva lactante. Los neonatos en estado crítico pueden requerir una infusión en bolo de dextrosa al 12,5% por vía intravenosa o intravenosa (0,1 a 0,2 ml/100 g o más), seguida de una infusión a velocidad constante de dextrosa al 1,25% o al 5% en una solución electrolítica equilibrada para evitar la hipoglucemia de rebote.
Las soluciones de dextrosa hipertónicas no deben administrarse por vía subcutánea porque puede producirse desprendimiento de tejidos.
La deshidratación se produce fácilmente en gatitos neonatos con hipoxia, hipotermia, diarrea, vómitos o reducción de la ingesta de líquidos. Los neonatos tienen mecanismos compensatorios pobres y una función renal inmadura. La producción diaria de orina en los gatitos de 1 mes de edad es de 25 mL/kg, en comparación con los 10 a 20 mL/kg de los gatos adultos.
Los neonatos también tienen mayores necesidades de fluidos que los adultos por razones tales como una mayor cantidad de agua corporal total (alrededor del 80% del peso corporal, en comparación con el 60% en los adultos), una mayor relación entre la superficie y el peso corporal, una mayor tasa metabólica y menos grasa corporal. El estado de hidratación puede ser difícil de evaluar en los pacientes más jóvenes.
La turgencia de la piel no siempre es una prueba fiable de la hidratación de los gatitos de menos de 6 semanas porque su piel contiene menos grasa y más agua que la de los adultos. Las membranas mucosas del gatito deben estar húmedas y ligeramente hiperémicas o rosadas. Unas membranas mucosas pálidas y una disminución del tiempo de relleno capilar indican al menos un 10% de deshidratación. La orina neonatal es normalmente incolora y clara; en los gatitos deshidratados, la orina puede ser más oscura con una gravedad específica >1,020.
Si el gatito está normotérmico y no está en estado de shock o colapso cardiovascular, pueden administrarse líquidos subcutáneos (SC) calentados, aunque la absorción es lenta en los gatitos jóvenes. Si no hay disfunción gastrointestinal, pueden administrarse líquidos orales calientes.
Estos métodos son especialmente útiles en los pacientes más jóvenes y pequeños (de menos de 4 semanas).
Si el gatito está de moderadamente a gravemente deshidratado y es lo suficientemente grande como para facilitar la terapia intravenosa, la administración de líquidos por vía intravenosa es la más eficaz. Se utiliza un mini-set (60 gotas/mL) con una bomba de fluidos o jeringa o una bureta. La vena cefálica o yugular puede cateterizarse con un catéter de 24, ¾ de pulgada o de 22, 1 pulgada. La solución de Ringer lactato es ideal para la rehidratación porque el lactato puede utilizarse como fuente de energía y, si es necesario, puede añadirse dextrosa al 1,25% o al 5%.
Los líquidos calientes pueden administrarse en forma de bolo intravenoso lento de 1 mL/30 g de peso corporal (30 a 45 mL/kg), seguido de una infusión de mantenimiento de 80 a 120 mL/kg/d (8 a 12 mL/100 g/d) más las pérdidas que se produzcan.11,16 Es importante supervisar de cerca la fluidoterapia; es fácil sobrehidratar a los gatitos jóvenes debido a su función tubular renal inmadura. El estado de hidratación puede controlarse por varios métodos, pero es útil pesar al gatito cada 6 u 8 horas en una balanza de gramos precisa, es útil y fácil . También pueden utilizarse mediciones seriadas de volumen celular y proteínas totales. Debe controlarse el estado de los electrolitos y la glucosa.
Si es difícil conseguir un acceso intravenoso, debe emplearse una vía alternativa para la administración de fluidos. La vía intraperitoneal debe utilizarse con precaución en los gatitos neonatos debido al riesgo de inducir una peritonitis o dañar los vasos sanguíneos. El acceso intraperitoneal utilizando la fosa trocantérica del fémur proximal es la mejor alternativa al acceso intravenoso en los gatitos más grandes; la sangre, los fluidos y los medicamentos pueden administrarse de esta manera, especialmente en los gatitos de unas 4 semanas de edad y mayores.Utilice una aguja espinal de 20 a 22 pulgadas o una aguja hipodérmica de 18 a 25 pulgadas como catéter. Se pueden conseguir flujos de hasta 11 mL/min por gravedad. El uso de fluidos fríos, un volumen demasiado grande en poco tiempo o soluciones hipertónicas o alcalinas provocará dolor. El acceso intravenoso debe establecerse lo antes posible.
Las complicaciones de la administración IO incluyen la infección, la extravasación de fluidos y el traumatismo de los huesos y los tejidos blandos. Las consideraciones prácticas, como la tolerancia al estrés, pueden dictar el uso de la administración de fluidos por vía SC, al menos inicialmente. Cuando se utiliza la vía SC se requiere una cuidadosa monitorización de la absorción de fluidos.
Las transfusiones de sangre pueden ser necesarias en algunos gatitos neonatales enfermos, especialmente en aquellos con anemia debida a pulgas o parásitos intestinales. Las indicaciones para las transfusiones de sangre son la debilidad, la taquicardia, la palidez de las membranas mucosas y un hematocrito <15%. La sangre de un donante de tipo compatible se diluye 9:1 con un anticoagulante de citrato y se administra utilizando un filtro de sangre de miliporo por vía intravenosa o IO a un ritmo de 20 mL/kg durante un mínimo de 2 horas.
Inmunidad
Los gatitos reciben casi toda su inmunidad pasiva durante las primeras 18 horas de vida (antes del cierre del intestino) con la ingestión de calostro; hay poca o ninguna transferencia transplacentaria de inmunoglobulinas en los gatos. El nadir de IgG en suero se alcanza alrededor de las 4 semanas de edad debido al catabolismo de la IgG materna y se correlaciona con un periodo de vulnerabilidad a la infección. Los niveles de IgG aumentan de forma constante a medida que se desarrolla la propia inmunidad adaptativa del gatito.
El fracaso de la transferencia pasiva puede ocurrir en gatitos que no han ingerido calostro durante las primeras horas críticas. La corrección del fallo de la transferencia pasiva puede realizarse mediante la inyección SC de suero de un gato adulto con un tipo de sangre compatible que haya sido examinado para detectar enfermedades infecciosas. En el único estudio publicado se utilizaron 15 mL/100 g de peso corporal, divididos en tres dosis durante 24 horas.18 Se desconoce la cantidad mínima necesaria.
Los gatitos con fallo de transferencia pasiva no corregido empiezan a producir IgG a las 4 semanas de edad aproximadamente; por lo tanto, son más vulnerables a la infección desde el nacimiento hasta al menos las 4 semanas de edad.
Gatitos huérfanos
Introducción
A los veterinarios se les puede pedir que evalúen y traten a gatitos jóvenes que han quedado huérfanos o abandonados. Los gatitos pueden quedar huérfanos si la madre
madre muere o está demasiado enferma para cuidar de su camada, o cuando se encuentran neonatos aparentemente abandonados en la calle.
El éxito del tratamiento puede lograrse con el conocimiento de las necesidades particulares de estos pacientes pediátricos, a menudo frágiles.
Examen y evaluación
Examen físico
El estado de un gatito huérfano debe evaluarse por completo en la primera oportunidad. Se debe intentar obtener toda la información posible sobre el gatito, aunque puede haber poca información disponible.
Preste especial atención al entorno en el que está alojado. Deben tenerse en cuenta factores como la temperatura y la humedad ambiental, el saneamiento, la densidad de población, el parasitismo y las enfermedades infecciosas.
Examine a los gatitos muy jóvenes con suavidad y paciencia sobre una superficie cálida y limpia. Lávese las manos antes de manipular al gatito y use guantes cuando realizar cualquier procedimiento.
Un equipo sencillo le ayudará en su examen, como una báscula de gramos, un termómetro digital, un otoscopio con conos para bebés, una linterna y un estetoscopio con campana para bebés (2 cm) y diafragma (3 cm).
Antes de manipular al gatito, observe su respuesta al entorno, así como su estado corporal, su mentalidad, su postura, su locomoción y su respiración.
Registre la frecuencia respiratoria antes de manipular al gatito, y luego registre la temperatura rectal y el corazón.
Intente establecer una edad estimada para el gatito utilizando el peso corporal y la inspección de la dentición.
El peso típico del gatito al nacer es de 90 a 110 g (rango 80-140 g). Los gatitos normales ganan entre 50 y 100 g por semana (10-15 g/día) y deberían duplicar su peso al nacer a las dos semanas de edad.
Los primeros dientes caducos que aparecen son los incisivos y los caninos a las 3 ó 4 semanas de edad. Los premolares erupcionan a las 5 ó 6 semanas de edad. La fórmula dental de los dientes caducos es 2 (I3/3, C1/1, P3/2); no hay molares caducos.
El pelo del gatito debe estar limpio y brillante.
Compruebe si hay pulgas, ya que una infestación grave puede causar anemia. Los gatitos neonatos sanos pueden tener las membranas mucosas hiperémicas hasta los 7 días de edad, mientras que los neonatos enfermos suelen tener las membranas pálidas, grises o membranas cianóticas.
Un abdomen lleno es normal en un gatito bien alimentado, pero un abdomen agrandado en un gatito enfermo puede indicar aerofagia. La hinchazón, el enrojecimiento o la secreción en el ombligo pueden ser signos de onfaloflebitis, un problema común en los gatitos neonatos. El cultivo de la secreción debe utilizarse para orientar la selección del tratamiento antibiótico. Inspeccionar al gatito para detectar cualquier anomalía anatómica grave, como paladar hendido, hernia umbilical, deformidades de las extremidades, deformidades de la pared torácica y aberturas urogenitales o rectales no patentes.
Los gatitos de menos de 3 semanas no pueden eliminar la orina y las heces voluntariamente. Evalúe los reflejos de micción y defecación de un gatito utilizando una bola de algodón con aceite mineral para estimular la zona anogenital. La diarrea está presente en aproximadamente el 60% de los gatitos neonatos enfermos. También puede haber hematuria o pigmenturia, que pueden ser signos de infección del tracto urinario o de isoeritrólisis neonatal.
Inspeccionar los ojos en busca de anomalías del globo o de los párpados y de conjuntivitis. Antes de que se abran los ojos, la secreción y los párpados sobresalientes son signos de oftalmia neonatal. Ablandar el exudado con compresas calientes y separar los párpados con cuidado. Aplicar una pomada antibiótica oftálmica como la tetraciclina al 1% (1/4 de pulgada, TID, 4-7 días). La córnea puede aparecer ligeramente nublada cuando los ojos se abren por primera vez. Es muy difícil examinar el fondo de ojo hasta que los gatitos tienen 6 semanas de edad o más. Los conductos auditivos no son fáciles de inspeccionar con un otoscopio hasta más de 4 semanas de edad.
La auscultación del corazón puede ser difícil en el neonato muy joven. Los soplos funcionales pueden estar presentes en los neonatos debido a la anemia, la hipoproteinemia, la fiebre o la sepsis. Las anomalías cardíacas congénitas tienden a producir soplos fuertes asociados a pulsos periféricos anormales y a un estrechamiento precordial. Los soplos inocentes no asociados a enfermedades son más frecuentes en los cachorros que en los gatitos. Véase la Tabla 2 para conocer los hitos normales del desarrollo de los gatitos.
Diagnóstico básico
Incluso en el caso de los gatitos pequeños, es posible realizar pruebas diagnósticas críticas. La extracción de sangre de la vena yugular puede realizarse utilizando una jeringa pequeña (de 1 ml o menos) con una aguja de calibre 25-26. Coloque al gatito en decúbito dorsal con las patas delanteras hacia el abdomen y la cabeza y el cuello extendidos. Aspirar la sangre lentamente para evitar colapsar la vena.
Pueden utilizarse unos 0,5 mL de sangre para las pruebas más críticas:
– PCV y sólidos totales
– Recuento sanguíneo completo (CBC): colocar una gota de sangre directamente de la jeringa en un sistema manual de hematología como el UnopetteTM (Becton, Dickinson) y hacer frotis de sangre
– Glucosa en sangre: utilizar un glucómetro portátil diseñado para realizar pruebas en casa.
Se observa una anemia fisiológica en los gatitos de 2 a 6 semanas de edad (nadir a las 4 a 6 semanas de edad). Los valores del hemograma se normalizan a los rangos de los adultos alrededor de los 3 a 4 meses de edad.
Véase la Tabla 3 para conocer los valores normales de química sérica y hematología en gatitos desde el nacimiento hasta las 8 semanas.
Recoger la orina para determinar la química, la evaluación del sedimento y la gravedad específica mediante una suave expresión manual o la estimulación de la zona urogenital.
Evitar la cistocentesis en gatitos muy jóvenes ya que es difícil inmovilizar al
paciente adecuadamente y existe un mayor riesgo de dañar la pared de la vejiga, lo que provocaría una fuga de orina hacia el abdomen. La gravedad específica de la orina es de 1,020 o inferior en las primeras semanas de vida; los valores normales de los adultos se alcanzan entre las 8 y 10 semanas de edad.

Debe examinarse una muestra de heces para detectar parásitos intestinales comunes, como Giardia, Isospora y ascárides, utilizando tanto la centrifugación como un frotis salino directo. Los gatitos de tan sólo 2 semanas de edad pueden sercon pamoato de pirantel (5-10 mg/kg por vía oral cada 2 semanas).
Problemas comunes y tratamiento Hipotermia
La hipotermia se produce cuando la temperatura rectal del gatito es inferior a 34,4oC (94oF) y se asocia con una respiración deprimida, una función deteriorada del sistema inmunitario, bradicardia e íleo. Los gatitos hipotérmicos deben ser recalentados lentamente, durante 30 minutos a 2 horas hasta alcanzar una temperatura rectal máxima de 36,3oC (101oF) para evitar la deshidratación. Una incubadora o una jaula de oxígeno es una buena manera de lograr el recalentamiento, pero también pueden utilizarse bolsas de agua caliente y lámparas de calor con una supervisión muy cuidadosa.
En el caso de los gatitos con hipotermia grave, pueden administrarse líquidos calentados a 35-37o C (95-98o F) por vía intravenosa (IV) o intraósea (IO) o en forma de enema. Nunca intente alimentar a un gatito hipotérmico, ya que la neumonía por aspiración es un riesgo importante.
Hipoglucemia
La hipoglucemia clínica se produce cuando la glucosa en sangre es inferior a 3 mmol/L (50 mg/dL), y es un problema común para los gatitos huérfanos o los neonatos enfermos debido a la función hepática inmadura del gatito y al rápido agotamiento de las reservas de glucógeno. La hipoglucemia puede estar causada por vómitos, diarrea, sepsis, hipotermia e ingesta nutricional inadecuada. Los gatitos con hipoglucemia estarán débiles y letárgicos, y pueden ser anoréxicos. Si el gatito no está hipotérmico ni deshidratado, administre un 5-10% de dextrosa por vía oral a razón de 1 mL/100g de peso corporal por hora mediante una sonda gástrica hasta que el gatito esté más fuerte y normoglucémico. A continuación, comience a alimentar al gatito con un sustituto de la leche (Figura 2). Los neonatos críticamente enfermos pueden requerir una infusión en bolo de 10-20% de dextrosa IV o IO (1 mL/ 100 g) seguida de 1,25 a 5% de dextrosa en una solución electrolítica equilibrada. Las soluciones de dextrosa hipertónicas no deben administrarse por vía subcutánea, ya que pueden producirse desprendimientos de tejidos.
Deshidratación
La deshidratación se produce fácilmente en los gatitos huérfanos y neonatos con diarrea, vómitos o reducción de la ingesta de líquidos. Los neonatos tienen pobres mecanismos de compensación y una función renal inmadura. El estado de hidratación puede ser difícil de evaluar en los pacientes más jóvenes. La turgencia de la piel no es una prueba fiable de hidratación para los gatitos de menos de 6 semanas de edad, ya que su piel tiene un mayor contenido de grasa y menor de agua en comparación con los adultos. Las membranas mucosas del gatito deben estar húmedas e hiperémicas o rosadas. Unas membranas mucosas pálidas y una disminución del tiempo de relleno capilar indican al menos un 10% de deshidratación. La orina neonatal es normalmente incolora y clara; en los gatitos deshidratados, la orina es oscura con una gravedad específica superior a 1,020.
Si el gatito está mínimamente deshidratado y es normotérmico, sin disfunción gastrointestinal, pueden administrarse líquidos calientes por vía oral o subcutánea. Si el gatito está de moderadamente a severamente deshidratado, la administración de fluidos IV es la más efectiva. Se utiliza un mini-set (60 gotas/mL) con una bomba de fluidos o jeringa o una bureta.
La vena cefálica o yugular puede cateterizarse con un catéter de 24 g 3/4 de pulgada o 22 g de 1 pulgada. La solución de Ringers lactato es ideal para la rehidratación, ya que el lactato puede utilizarse como fuente de energía; si es necesario, puede añadirse dextrosa al 1,25-5%. Los fluidos intravenosos calentados pueden administrarse en forma de bolo de 30-40 mL/kg (3-4 mL/100g de peso corporal), seguidos de una infusión de mantenimiento de 80 mL/kg/día (8 mL/100g) más las pérdidas en curso. Es importante vigilar de cerca la fluidoterapia, ya que es fácil sobrehidratar a los gatitos jóvenes.
El estado de hidratación puede controlarse por varios métodos, pero es importante pesar al gatito cada 6 a 12 horas y es fácil de realizar. Otros métodos son las mediciones seriadas de PCV/proteínas totales, la medición de la presión venosa central y la medición de la diuresis con la colocación de una sonda urinaria de goma roja de 3,5 F. También debe controlarse el estado de los electrolitos y la glucosa. Si es difícil conseguir un acceso intravenoso, debe emplearse una vía alternativa para la administración de fluidos. La vía intraperitoneal no debe utilizarse en gatitos neonatos debido al riesgo de inducir una peritonitis.
El acceso intraóseo utilizando la fosa trocantérica del fémur proximal es la mejor alternativa al acceso intravenoso; la sangre, los fluidos y los medicamentos pueden administrarse de esta manera. Utilice una aguja espinal de 20 a 22 pulgadas o una aguja hipodérmica de 18 a 25 pulgadas como catéter. Se pueden conseguir flujos de hasta 11 mL/minuto por gravedad.
El uso de fluidos fríos, un volumen demasiado grande en poco tiempo o soluciones hipertónicas o alcalinas provocará dolor. El acceso intravenoso debe establecerse lo antes posible. Las complicaciones de la administración de IO incluyen la infección, la extravasación de fluidos y el traumatismo.
Enfermedades infecciosas
Las mayores tasas de mortalidad por enfermedades infecciosas se dan en las dos primeras semanas de vida y en el periodo posterior al destete (Figura 3). Los patógenos más comunes son:
Micoplasma, herpesvirus felino 1 (FHV-1), calicivirus, virus de la panleucopenia felina, peritonitis infecciosa felina,
Toxoplasma, E. coli, Pasteurella, Staphylococcus, Streptococcus, Bordetella, Chlamydophila. Los patógenos más importantes son el Streptococcus canis (grupo G, beta-hemolítico), las bacterias coliformes (por ejemplo, E. coli) y las infecciones respiratorias, especialmente el FHV-1.
El tratamiento farmacológico en los neonatos se ve afectado por varios factores importantes que influyen en la absorción, la distribución, la unión y el metabolismo del fármaco. En general, la administración IV o IO es más predecible que la oral, SC o
intramuscular (IM). La mayoría de los medicamentos no se han estudiado en gatitos neonatos, por lo que las recomendaciones de dosis y frecuencia suelen ser extrapolaciones. Normalmente, las dosis para adultos se reducen en un 30-50% o se aumenta el intervalo de dosificación. Algunos antibióticos deben evitarse en los gatitos jóvenes, como los aminoglucósidos, el cloranfenicol, las tetraciclinas y las sulfonamidas potenciadas. Los antibióticos recomendados para su uso en gatitos jóvenes incluyen las quinolonas y, -lactámicos (véase la Tabla 4 para información sobre la dosificación).
Inmunidad
Los gatitos reciben casi toda su inmunidad pasiva durante las primeras 18 horas de vida (antes del cierre del intestino) con la ingestión de calostro; hay poca transferencia transplacentaria de inmunoglobulinas en el gato. El nadir de IgG en suero se alcanza a las 5 semanas de edad y se correlaciona con un periodo de vulnerabilidad a la infección.
El fracaso de la transferencia pasiva puede ocurrir en gatitos huérfanos que no han ingerido calostro durante las primeras horas críticas. La corrección del fallo de la transferencia pasiva puede lograrse mediante la inyección SC de suero de gato adulto de un gato con un tipo de sangre compatible que haya sido examinado para detectar enfermedades infecciosas (15 mL/100 g de peso corporal, divididos en tres dosis durante 24 horas).
Los gatitos con fallo de transferencia pasiva no corregido empiezan a producir IgG alrededor de las 4 semanas de edad; por lo tanto, son más vulnerables a la infección desde el nacimiento hasta las 6 semanas de edad. La mayoría de los huérfanos deberían comenzar un programa de vacunación rutinario entre las 6 y las 8 semanas de edad.
Nutrición
Los gatitos huérfanos deben ser alimentados con un sustituto de leche comercial diseñado específicamente para gatitos, como Royal Canin Vital Milk. Deben seguirse las instrucciones del fabricante en cuanto a la mezcla, el almacenamiento y las cantidades de alimentación.
Las necesidades energéticas de los gatitos en las primeras semanas de vida son de aproximadamente 20 kcal ME/100 g de peso corporal/día. La necesidad de agua es de 180 mL/kg al día. Inicialmente, sólo debe administrarse el 50% de la cantidad normal de sustituto de leche para evitar inducir la diarrea. Puede añadirse agua adicional o una solución electrolítica oral para compensar el volumen y satisfacer las necesidades de líquidos. A lo largo de varias tomas, la concentración de la fórmula puede aumentar hasta la recomendada por el fabricante.
El sustituto de leche reconstituido debe calentarse a 35-38 ºC sumergiendo el recipiente en un baño de agua caliente. Nunca se debe calentar la fórmula en el microondas, ya que puede producirse un sobrecalentamiento. Los huérfanos vigorosos con un buen reflejo de succión pueden ser alimentados con el biberón en decúbito esternal con la cabeza elevada, simulando una posición normal de lactancia.
Los gatitos más débiles se alimentan mejor con una sonda gástrica. Las sondas de alimentación deben seleccionarse en función del tamaño del gatito: 5 Fr para los gatitos que pesan menos de 300 g, 8 Fr para los gatitos de más de 300 g. La fórmula se extrae en una jeringa de 3 o 10 ml que se conecta a la sonda de alimentación.
Mida desde la punta de la nariz del gatito hasta justo antes de la última costilla y marque esta posición en la sonda de alimentación. La sonda deberá volver a medirse y marcarse semanalmente a medida que el gatito crezca. La sonda se llena con sustituto de leche caliente y el gatito se coloca en decúbito esternal con la cabeza elevada. La sonda debe pasar fácilmente por el lado izquierdo de la boca hasta el esófago, y se hace avanzar hasta la marca. La fórmula se infunde lentamente. Antes de retirarla, la sonda debe doblarse para evitar la aspiración de la fórmula.
Evite la sobrealimentación; la capacidad máxima del estómago de los gatitos es de unos 4 mL/100 g de peso corporal. Los gatitos deben ser alimentados cada 2 ó 4 horas durante la primera semana de vida, y con menor frecuencia a partir de entonces. La diarrea es el problema más común que se observa en los gatitos alimentados con sustituto de leche. Puede tratarse reduciendo temporalmente la cantidad suministrada y diluyendo la fórmula en un 50% con agua o solución electrolítica durante algunas tomas.
Los gatitos huérfanos deben pesarse cada 12 horas para asegurarse de que la nutrición es adecuada para el crecimiento. A los huérfanos de menos de 3 semanas de edad se les debe estimular la zona anogenital después de cada comida para inducir la defecación y la micción. A las 3 ó 4 semanas de vida, puede introducirse la comida para gatitos mezclando una pequeña cantidad de alimento con la fórmula y ofreciéndola en un platillo. Una vez que el gatito haya aprendido a comer en un platillo, la cantidad de leche artificial puede reducirse lentamente hasta que sólo ingiera alimentos sólidos.
El destete suele completarse entre las 6 y las 8 semanas de edad.
Infertilidad en hembras
Registro de datos
Los registros sanitarios y de cría son muy importantes; los criadores de gatos de raza necesitan un sistema sencillo pero completo para registrar los datos de cada gato de cría.
Registro individual para cada gato:
- Nombre y nombre registrado; número de registro; número de microchip
- Descripción completa y foto
- Fecha de nacimiento
- Padre y madre
- Registro de vacunación y desparasitación
- Registro de los principales problemas de salud y su tratamiento
- Registro de procedimientos electivos (por ejemplo, limpiezas dentales, esterilizaciones, etc.)
Los registros adicionales de los gatos de cría deben incluir como mínimo:
a. Edad en el primer celo.
b. Registro de cada celo y de los planes de cría.
c. Registro de cualquier problema de salud durante la gestación y de los medicamentos administrados.
d. Registro de cada cría (nombre del macho, fechas de cría, número de crías, si la cría fue presenciada, cualquier problema) y su resultado (es decir preñez o fecha de retorno al celo).
e. Registro de cada embarazo (fecha prevista de parto, fecha real de parto, número demgatitos nacidos vivos/muertos, cualquier defecto congénito u otros problemas).
f. Descripción de cada parto (duración, intervenciones necesarias, etc.).
g. Fechas/resultados de cualquier radiografía/ultrasonido realizado por motivos reproductivos.
h. Peso al nacer de los gatitos, problemas de salud en el periodo neonatal.
i. Estado de salud de cada gatito a los 1 y 5 años de edad, si se conoce.
Infertilidad
La infertilidad puede significar uno de los siguientes aspectos en las gatas:
- Incapacidad de ser reproducida por un macho.
- Incapacidad de concebir después de una reproducción exitosa.
- Incapacidad de llevar un embarazo a término.
- Las gatas difíciles de criar pueden producir otras gatas difíciles de criar.
La investigación de la infertilidad en la madre requiere:
- Un examen físico completo y un historial médico exhaustivo (incluyendo los fármacos o productos herbales administrados y el historial de vacunación).
- Química sanguínea, recuento sanguíneo completo, análisis de orina, pruebas de retrovirus.
- Citología vaginal, progesterona sérica para establecer la fase del ciclo estral.
- Evaluación de la dieta, el alojamiento, el estrés de las exposiciones y los viajes.
- Evaluación de las interacciones sociales con otros gatos en el criadero.
- Evaluación del comportamiento reproductivo cuando está con el macho.
- Evaluación del entorno del criadero: temperatura, ventilación, luz disponible, densidad de población, diseño de la jaula, etc.
- Recursos para entornos felinos interiores saludables.
Fallo en el ciclo
- Inmadurez: El primer celo puede ocurrir en cualquier momento entre los 4 y los 21 meses de edad.
- Senilidad: Las madres de más de 8 años pueden tener ciclos de celo ausentes o poco frecuentes.
- Ovariectomía u ovariohisterectomía previa: La hormona luteinizante (LH) en suero será más de 1 ng/ml en hembras con OHE/ovariectomía debido a la pérdida de retroalimentación negativa de los ovarios.
- Anestro primario verdadero: Las madres que no muestran el primer celo a los 24 meses de edad (poco común); evaluar el cariotipo para detectar anomalías cromosómicas.
- Anestro secundario: falta de ciclos o ciclos infrecuentes.
Celo silencioso:
Eventos hormonales normales sin celo de comportamiento.
- Reinas tímidas, bajas en la escala social del criadero; condiciones de hacinamiento
- Debe diferenciarse de la pseudopreñez debida a la ovulación espontánea
- Alojar a la madre con diferentes gatos (grupo más pequeño) o por separado; exponerla al macho.
Luz diurna inadecuada:
- El alojamiento en interiores puede no garantizar suficientes horas de luz diurna.
- Se necesitan entre 14 y 16 horas de luz artificial; el equivalente a una bombilla de 100 vatios por espacio de 13 x 13 pies; si se puede leer un periódico, es suficiente luz.
Ovulación espontánea/pseudoembarazo:
- La ovulación no copulativa puede ser una causa de largos intervalos de interés (40-50 días).
- Detectar con citología vaginal y progesterona sérica elevada en
ausencia de embarazo confirmado.
Enfermedades intercurrentes/estresantes:
- Las afecciones que causan debilitamiento o enfermedad prolongada de salud pueden afectar a los ciclos estrales.
- Factores estresantes como la exposición/viaje frecuente.
- Hacinamiento.
- Interacciones antagónicas con otros gatos también pueden suprimir los ciclos.
Medicamentos:
Algunos medicamentos pueden interferir con los ciclos estrales suprimiendo la secreción de gonadotropinas, como los;
- Corticosteroides.
- Progestinas.
- Esteroides anabólicos.
- Los andrógenos.
- Algunos antifúngicos como el ketoconazol pueden reducir los niveles de testosterona.
- Griseofulvina podría inhibir la espermatogénesis.
- La cabergolina (Galastop®, Boehringer Ingelheim) puede ser útil para inducir el celo, no está bien estudiada en la madre
La FSH puede utilizarse para inducir el celo en la madre, pero su uso prolongado se ha asociado con ovarios quísticos:
– Día 1: 2,0 mg, IM; Días 2 y 3: 1,0 mg, IM; Días 4 y 5: 0,5 mg, IM
Celo prolongado o persistente
1. Fenómeno normal:
- Puede deberse a intervalos de interestrus muy cortos o a la receptividad al apareamiento durante la fase no folicular del ciclo estral.
- Investigar mediante citología vaginal, niveles de estradiol en suero cada 2-3 días durante un periodo de 3-4 semanas.
- Aparear a la madre con un macho experimentado o inducir la ovulación con GnRH (25 μg por vía intramuscular).
- Intentar inducir el anestro manteniendo a la madre con menos de 8-10 horas de luz.
2. Quistes y tumores ováricos:
- Las gatas pueden tener quistes ováricos y parováricos tanto funcionales como no funcionales;Los tumores son más comunes en las hembras mayores.
- Evaluar con ultrasonografía, niveles de estradiol en suero.
Falta de concepción con un ciclo normal:
1. Anomalías maternas:
- Defectos congénitos: himen persistente, estenosis vaginal
- Depresión endogámica: la endogamia intensiva puede causar subfertilidad, pérdida de vigor
y capacidad reproductiva - Enfermedad uterina: hiperplasia endometrial quística (HCE)/piometra.
a.Ultrasonido del útero (grosor de la pared uterina, acumulación de líquido)
b. Laparoscopia o laparotomía para visualizar el tracto reproductivo, biopsia/cultivo del útero (para reinas valiosas)
c. Las madres con pseudoembarazos repetidos pueden tener HSC
d. Ultrasonido 18-21 días después de la cría para diferenciar la falta de concepción de la muerte fetal temprana
2. Infertilidad masculina:
criar a la madre con un macho probado (que haya engendrado gatitos en los últimos 6 meses).
meses); comprobar si el macho tiene un anillo de pelo alrededor de la base del pene que puede impedir la intromisión.
3. Problemas de gestión de la cría:
– Revisar el manejo de la cría, grabar en video las crías si es necesario
– La reina temerosa puede no criar, el miedo afecta a los eventos hormonales; las reinas dominantes pueden
Las reinas dominantes pueden requerir sedación para permitir que el macho críe (se desconoce la mejor medicación a utilizar)
– Se sabe que hay preferencias y aversiones de pareja
– Si la madre vuelve al celo menos de 21 días después de la cría, no ha ovulado probablemente se deba a una cría inadecuada (crías incompletas, muy pocas crías)
– Comprobar el momento de la cría (demasiado pronto, demasiado tarde); lo mejor es criar los días 2-4
– Compruebe la progesterona sérica 1-2 semanas después de la cría para ver si se produjo la ovulación;
la ovulación está asociada a una progesterona sérica > 2 ng/ml
4. No hay ovulación:
Si se han descartado los problemas de manejo de la cría como causa,
la ovulación puede ser inducida con GnRH o hCG
– Los tratamientos repetidos se han asociado con disminuciones inmunológicas en fertilidad.
5. Resorción/aborto fetal:
La madre vuelve al celo 60+ días después de la cría.
Hiperplasia Endometrial Quística (HEC).
Trastorno de cambios proliferativos y degenerativos en el endometrio asociados con el envejecimiento; condición crónica subclínica; común en reinas de más de 5 años y reinas solteras de más de 3 años, pero puede hembras de más de 3 años, pero puede verse a cualquier edad.
La progesterona induce la hiperplasia del epitelio superficial o glandular y la dilatación quística
dilatación de las glándulas uterinas; el líquido de las estructuras quísticas no suele estar contaminado, pero si está libre en el útero, favorecerá el crecimiento bacteriano; la progesterona también inhibe la respuesta inmunitaria local y disminuye la contractilidad del miometrio
Los pseudoembarazos repetidos pueden predisponer a algunas madres a la HEC; las progestinas utilizadas para controlar el celo también son un factor de riesgo
Diagnóstico: la madre no está enferma pero no concibe o tiene camadas pequeñas; la ecografía puede detectar un engrosamiento del útero; el diagnóstico definitivo sólo es posible con una biopsia uterina
No hay tratamiento para la HSC no complicada; la endometritis (HSC más infección bacteriana) puede responder a un tratamiento antibiótico prolongado, pero puede evolucionar a piometra.
Piometra
Infección endometrial grave con acumulación de pus en el útero
Suele producirse tras un celo, cuando las bacterias de la vagina invaden el útero
a través del cuello uterino abierto; suele estar asociada a la HEC
La vagina normalmente tiene bacterias presentes; por lo tanto, los cultivos vaginales son difíciles de interpretar;
las bacterias más comunes son E. coli y Streptococcus, Staphylococcus, etc.
Signos clínicos: Secreción vulvar (si el cuello uterino está abierto), depresión, deshidratación, anorexia
fiebre, pérdida de peso, abdomen distendido
Diagnóstico: Aumento del recuento de glóbulos blancos, aumento del tamaño del útero en las radiografías o la ecografía
Tratamiento: Pueden ser necesarios líquidos intravenosos, antibióticos (fluoroquinolonas, amoxicilina-
clavulanato) más ovariohisterectomía (OHE) o terapia con prostaglandinas para reinas reproductoras valiosas
Antibióticos solos, duchas vaginales poco eficaces
Terapia con prostaglandinas: mejor para el cérvix abierto; ¡la tasa de complicaciones es baja!
Las reinas candidatas deben tener menos de 6 años, gozar de buena salud (sin asma), no tener fetos retenidos
fetal retenido o fetos vivos, sin complicaciones (por ejemplo, torsión uterina)
– Tratamiento con prostaglandina F2α, dinoprost (Lutalyse ®, Pharmacia & Upjohn): la reina puede o no ser hospitalizada; diferentes opciones de dosificación:
Dosis alta: 0,1 a 0,25 mg/kg SC dos veces al día durante 5 a 7 días
Dosis baja: 0,02 a 0,05 mg/kg SC 4-6 veces al día durante 5 a 10 días
– El tratamiento puede provocar la apertura del cuello uterino, la contracción del útero y la lisis del CL.
– Vigilar: aumento de la fiebre, dolor abdominal, enfermedad sistémica, rotura uterina
– Evaluar el éxito del tratamiento mediante el control de los recuentos de glóbulos blancos y la ecografía
– Efectos secundarios comunes a dosis más altas, especialmente el primer día: inquietud, vocalización
jadeo, vómitos, diarrea, salivación, acicalamiento intenso de los flancos y la vulva; dura
15-20 minutos; los efectos secundarios son infrecuentes a dosis bajas (a menudo sólo un poco de salivación)
– Volver a examinar a la gata 1 y 2 semanas después del tratamiento: secreción vulvar clara al 7º día,
normal a los 14 días; si persiste la secreción sanguinolenta o purulenta, tratar de nuevo
– Criar en el siguiente celo. Las tasas de fertilidad después del tratamiento son buenas (80% o más)
– Terapia coadyuvante:
Terapia antibiótica oral prolongada (4-6 semanas)
Cabergolina (Galastop®, Boehringer Ingelheim): 5 μg/kg, PO, 5 días; inhibidor de la prolactina, luteolítico, sin efectos secundarios
Aglepristona (Alizine®, Virbac): antagonista de los receptores de progesterona, 10-15 mg/kg, SC, 2 días seguidos
La selección de buenos reproductores
La Selección de Buenos Reproductores
por Susan Little
Antes de seleccionar el grupo, es importante tener en cuenta el número de animales en el criadero, su estado de salud general, sus interacciones entre sí y los aspectos que hemos revisado anteriormente en este artículo.
El reto es no añadir animales sin una razón, y no sobrepoblar el criadero con animales que no hacen avanzar su programa de cría. El recordatorio que he utilizado es decidir cuántos animales conforman un buen programa de cría para el criadero y colocar ese número en el frigorífico donde se pueda mirar diariamente.
Si el número se excede, entonces uno de los animales actuales tendrá que ser esterilizado o castrado y colocado en un buen hogar.
Tanto si está seleccionando gatos de fundación para un nuevo criadero como si está contemplando la posibilidad de añadir reproductores a un criadero ya establecido, es importante entender cómo seleccionar los reproductores.
Los criadores pueden empezar por identificar claramente sus objetivos específicos cuando consideren la incorporación de nuevos reproductores. Entre las habilidades importantes que debe adquirir el criador se incluyen una buena comprensión del estándar de la raza, la capacidad de reconocer excelentes ejemplos de la raza y la capacidad de juzgar a los propios gatos de forma imparcial para reconocer sus puntos fuertes y débiles.
También es importante mantener registros de cría y salud precisos para que la información esté disponible para los criterios de selección.
Los criaderos pueden necesitar nuevos reproductores por varias razones:
1. Para mejorar el aspecto general de los gatos en comparación con el estándar de la raza.
2. Para mejorar el rendimiento reproductivo del criadero.
3. Mejorar la salud general de los gatos producidos.
Hay varias formas en las que los criadores pueden añadir nuevos reproductores a un criadero:
1. Seleccionando un gatito producido dentro del criadero.
2. Comprando un nuevo gatito a otro criadero.
3. Comprando un gato maduro de otro criadero.
4. Utilizar el servicio de sementales externos para las hembras del criadero con la intención de tener gatitos para la cría.
5. La selección implica la elección de gatos para la cría sobre la base del mérito individual o sobre la base del rendimiento y las características de la familia.
En general, la selección provoca una pequeña disminución de la heterocigosidad, la perpetuación de ciertos genes y el aumento de la similitud.
Los gatos maduros pueden ser seleccionados principalmente por sus méritos individuales, mientras que los gatitos pueden ser seleccionados principalmente por su rendimiento familiar.
Los criterios de selección deberían incluir la salud, el rendimiento reproductivo y el fenotipo.
En general, los criadores que tienen éxito seleccionan hacia un estándar de raza basado en el buen temperamento y la buena conformación, y se alejan de los problemas de salud relacionados con la raza y de otros factores perjudiciales (mal temperamento, mal rendimiento reproductivo, etc.).
El primer objetivo del criador exitoso es la selección para la buena salud y el temperamento. Los buenos reproductores son sanos y tan libres de defectos hereditarios como sea posible.
Seleccione contra los reproductores con:
1. Mala salud general, susceptibilidad a las enfermedades infecciosas.
2. Cualquier defecto hereditario (incluyendo criptorquidia).
3. Mal temperamento con otros gatos o con las personas.
4. Defectos o anomalías de conformación.
Vea físicamente a tantos hermanos o parientes como sea posible para tener un buen conocimiento del fenotipo de las líneas que está contemplando. En el caso de los gatitos jóvenes, no siempre será posible evaluar completamente estos factores hasta que el gatito sea maduro.
Por lo tanto, puede evaluar estos factores en los parientes más cercanos del gatito, especialmente los padres y los hermanos completos.
Compruebe el estado de salud de la camada para ver si todos han crecido con normalidad y están libres de enfermedades desde su nacimiento. Los gatitos con trastornos oculares o mala salud no son buenos candidatos para los programas de cría.
Un gato que se considere para un potencial nuevo plantel de cría debería ser:
1. Libre de signos de enfermedad (como infecciones de las vías respiratorias superiores, diarrea, tiña, etc.).
2. Haber dado negativo en las pruebas del virus de la leucemia felina y del virus de la inmunodeficiencia felina.
3. Testado negativo para parásitos intestinales.
4. En buena condición corporal.
5. Libre de enfermedades genéticas asociadas a la raza, como la poliquistosis renal, la displasia de cadera, la cardiomiopatía hipertrófica, etc.
6. Se ha realizado un análisis del grupo sanguíneo, si la raza tiene una cantidad significativa de gatos del grupo sanguíneo B.
A menudo se pasa por alto el rendimiento reproductivo cuando se seleccionan nuevos reproductores. Si no se tiene cuidado, un rendimiento reproductivo deficiente puede propagarse a las generaciones futuras.Se ha sugerido que el rendimiento reproductivo no puede ser evaluado completamente hasta que un gato haya producido al menos 3 camadas.
Las madres que tienen un bajo rendimiento reproductivo en la tercera camada tienen pocas probabilidades de mejorar.
Los gatitos jóvenes deben ser evaluados por el rendimiento reproductivo de sus parientes cercanos.
Evalúe a los machos jóvenes por el rendimiento del padre y de los hermanos completos.
Evaluar a las hembras jóvenes por el rendimiento de la madre y de las hermanas completas. Seleccione machos y hembras maduros que tengan buena libido, buen comportamiento reproductivo y buena fertilidad (media o superior a la media del criadero o de la raza).
El macho semental es el gato más importante del criadero por simple estadística. El macho semental puede engendrar muchas más crías en su vida que cualquier hembra. En general, los criadores necesitan aplicar estándares más altos de salud, rendimiento reproductivo y fenotipo cuando seleccionan un macho semental, y si no está a la altura, estar preparados para castrarlo en favor de una cría u otra incorporación al criadero.
Su hermano u otro hermano podría ser un mejor candidato para la cría que el propio gato de exposición. Un secreto para mantener un buen plantel de cría disponible en estos tiempos inciertos es mantener un compañero de camada (macho o hembra) cuando se está exponiendo otro gato con gran intensidad, de modo que el animal de cría esté disponible para el criadero si le ocurre algo al gato de exposición. Esto también puede lograrse mediante un grupo de criaderos que trabajen juntos.
Las hembras maduras que se consideren como nuevos reproductores tienen:
1. Ciclos estrales normales.
2. Parto normal: sin antecedentes de complicaciones en el parto.
3. Buenas aptitudes para la maternidad: sin antecedentes de canibalismo o abandono.
4. Producción normal de leche.
5. Peso normal de los gatitos al nacer, bajas tasas de mortalidad neonatal.
- Potencia es el término utilizado para describir a un gato macho o hembra que posee la capacidad de producir crías con un gran parecido a ese progenitor. El término se aplica más a menudo a los tomales porque es más fácil reconocer este rasgo en ellos debido al mayor número de crías que producen.
- La potencia puede producirse a medida que un individuo se vuelve más homocigótico tanto para los rasgos dominantes como para los recesivos.
- La potencia puede ser un activo valioso en un gato de cría, pero recuerde que tanto los rasgos buenos como los malos se reproducen en la descendencia.
Utilizar un macho potente de fenotipo superior puede mejorar la apariencia de los gatitos producidos por un criadero, y utilizar un macho conocido por producir gatitos sanos puede beneficiar la salud a largo plazo de un criadero y de una raza.
El popular efecto de los sementales (o «ganadores») se produce cuando un determinado gato semental se utiliza en exceso en la población de cría. Los sementales pueden llegar a ser populares porque son gatos ganadores o han engendrado muchos ganadores o porque son conocidos por estar libres de ciertas enfermedades genéticas.
Los programas de reconocimiento, como el programa de Mérito Distinguido de la Asociación de Aficionados a los Gatos (CFA), pueden realmente animar a los criadores a recurrir a ciertos gatos debido a su probado historial. Sin embargo, estos programas sólo reconocen la capacidad de producir ganadores de concursos, no la salud general del gato, ni su rendimiento reproductivo, por lo que hay que tener cuidado.
En las razas menos pobladas, el efecto del uso excesivo de ciertos gatos puede ser muy amplio. Cuando los genes de un gato se propagan ampliamente, cualquier recesivo perjudicial desconocido que el macho lleve también se propagará, quizás para ser descubierto en futuras generaciones.
Este puede ser el motor de un nuevo defecto genético. Los sementales populares también bloquean las contribuciones de otros sementales y puede producirse un cuello de botella artificial en la población.
Piometras
Hiperplasia Endometrial Quística/Piometra Susan Little DVM Diplomada ABVP (Felina) Bytown Cat Hospital Ottawa, Canadá.
a) Etiología:
Normalmente se ha creído que, debido a que los gatos son ovuladores inducidos, la incidencia de la hiperplasia endometrial quística (HEC)/piometra es menor que en los perros.
Sin embargo, estudios recientes han demostrado que muchas gatas también son ovuladoras espontáneas y, por lo tanto, pueden experimentar periodos diestrales prolongados sin embarazo.
Los pseudoembarazos repetidos pueden predisponer al útero a la HSC, que es un trastorno de cambios proliferativos y degenerativos en el endometrio asociados al envejecimiento.La mayoría de las hembras con piometra estuvieron en celo en algún momento de los 60 días anteriores.
Potter et al (1991) informaron que el 40% (16/40) de las hembras con piometra o endometritis tenían CL. Lawler et al (1991) informaron que el 67% (20/30) de las reinas con piometra tenían ovarios en fase lútea.
La progesterona causa hiperplasia del endometrio y de las glándulas endometriales.
Otros efectos de la progesterona son la inhibición de la respuesta local de los leucocitos a la infección en el útero y la disminución de la contractilidad del miometrio.
El estradiol provoca un aumento del número de receptores de estrógeno y progesterona en el endometrio. También provoca la dilatación cervical durante el celo y, por tanto, permite que las bacterias que forman parte de la flora normal de la vagina (especialmente E. coli y Streptococcus spp) asciendan al útero.
Es normal que las gatas tengan tanto bacterias aeróbicas como anaeróbicas en la vagina.
Las gatas más jóvenes tienen más bacterias vaginales que las mayores, y las gatas en celo o preñadas tienen más bacterias que las gatas en anestro.
Por lo tanto, los cultivos vaginales son difíciles de interpretar, ya que la gata tiene una flora bacteriana normal.
Esta combinación de bacterias ascendentes y un endometrio anormal predispone a las gatas a la piometra.
b) Síntomas clínicos y diagnóstico:
Los gatos con HSC pueden o no tener endometritis.
La HSC tiende a ser una condición crónica y subclínica y puede ser difícil de diagnosticar definitivamente sin una biopsia del útero.
El diagnóstico presuntivo de endometritis puede hacerse a partir de la respuesta al tratamiento antibiótico, que debe durar entre 2 y 4 meses.
La patología uterina, en su mayoría secundaria a HEC y endometritis, es común en gatas de más de 5 años de edad.
La HSC es muy común en las hembras no montadas de más de 3 años de edad. Pérez et al (1999) encontraron que el 88,2% de las hembras mayores de 5 años en colonias de cría tenían HSC, frente a una incidencia del 30% en hembras de 2-4 años.
Un grupo de gatas asilvestradas también muestreadas no tenían HSC.
Llegaron a la conclusión de que las gatas de las colonias mostraban una predisposición a la HSC que se correlacionaba con elevadas concentraciones de estradiol en suero.
La HSC es una de las causas más importantes de infertilidad en los criaderos.
Las gatas con CEH avanzado a veces presentan mucometra o hidrometra, caracterizadas por cantidades variables de moco en el útero.
En la hidrometra, la mucina es fina y acuosa.
En la mucometra, la mucina es espesa o incluso semisólida.
Las hembras con cualquiera de las dos afecciones no tienen infecciones bacterianas y no son sistémicas.
El síntoma principal es la distensión abdominal, con o sin flujo vaginal.
Los signos clínicos de la piometra incluyen una descarga vulvar, depresión, deshidratación, anorexia, fiebre, pérdida de peso y un abdomen distendido.
Cualquier flujo vulvar anormal en una hembra intacta debe suponerse que se debe a la piometra.
Sin embargo, entre el 15 y el 30% de las hembras no tienen secreción vulvar (cuello uterino cerrado).
Las gatas son a menudo muy meticulosas en el aseo, por lo que la evidencia de la descarga puede ser difícil de encontrar.
Un número sorprendente de gatas con piometras de cuello abierto tienen pocos o ningún signo de enfermedad sistémica.
Muy ocasionalmente, la piometra se encuentra durante un examen sanitario anual de rutina.
La poliuria y la polidipsia son mucho menos frecuentes en las hembras con piometra que en las perras.
La mayoría de las hembras con piometra presentan una leucocitosis con desviación a la izquierda.
El diagnóstico puede afirmarse al encontrar un útero agrandado en las radiografías o la ecografía.
En algunos casos, el agrandamiento del útero es segmentario, imitando un embarazo.
En ocasiones, sólo está afectado un cuerno del útero.
Los gatos que tienen HSC pero no piometra pueden ser normales en la exploración física.
Sus análisis de sangre y orina son normales.
La ecografía del abdomen es muy sensible para detectar el agrandamiento del útero.
Las radiografías no son tan útiles, pero poder ver el útero en una radiografía suele indicar que el útero está agrandado. El diagnóstico final no suele hacerse hasta que se realiza una cirugía exploratoria y se extrae el útero y/o se realiza una biopsia.
c) Tratamiento:
No existe un tratamiento específico para la HSC.
En teoría, un período prolongado de anestro puede permitir una cierta normalización del endometrio.
Deben evitarse los progestágenos.
La mibolerona es eficaz para inducir el anestro en las gatas, pero se asocia con graves efectos adversos.
Mantener a las gatas con menos de 10 horas de luz diurna puede inducir un fotoperiodo anestro.
El tratamiento inicial de la piometra puede incluir líquidos intravenosos y antibióticos.
Dado que la E. coli es la bacteria más comúnmente implicada, las buenas opciones de antibióticos son la enrofloxacina (Baytril®), trimetoprim-sulfa (Tribrissen®) o clavulanato-amoxicilina (Clavamox®).
No suele ser necesario realizar un cultivo y una prueba de sensibilidad en la secreción uterina.
La antibioterapia sola para la piometra no suele tener éxito.
Las duchas vaginales con antisépticos o antibióticos-soluciones tampoco son eficaces.
Una serie de 183 gatas (Kenney et al, 1987) con piometra encontró una tasa de mortalidad del 8%, más comúnmente asociada a la rotura del útero y a la peritonitis.
Para el tratamiento de la piometra pueden adoptarse dos enfoques: la ovariohisterectomía y la terapia con prostaglandina.
i) La ovariohisterectomía proporciona los resultados más consistentes, ya que el origen del problema se elimina permanentemente y las gatas se recuperan rápidamente. Para las reinas que no son valiosas para un programa de cría, ésta es probablemente la mejor opción.
ii) La terapia con prostaglandinas ha sido el tratamiento más exitoso para la piometra de cérvix abierto cuando se desea preservar la futura fertilidad de la reina.
Las tasas de éxito para el retorno a la fertilidad pueden ser tan altas como el 86%. La prostaglandina F2 (PGF2) se ha utilizado tanto para la piometra como para la metritis posparto.
Las mejores gatas para esta terapia son las menores de 6 años, con buena salud y sin material fetal retenido si son posparto (la ecografía es muy útil para determinar esto).
La terapia con PGF2 está contraindicada en gatas con algunas condiciones médicas como el asma.
La terapia con PGF2 no debe utilizarse si la gata está en malas condiciones o está críticamente enferma.
La evaluación cuidadosa de la paciente es crítica para descartar condiciones que podrían excluir el uso de PGF2.
Por ejemplo, en raros casos, la piometra está asociada a la torsión uterina, una contraindicación para el tratamiento con PGF2.
El tratamiento de la piometra de cuello cerrado sólo debe llevarse a cabo con precaución, y sólo en gatas médicamente estables, jóvenes y por lo demás sanas.
Si el cuello del útero no se abre después de unos días de tratamiento, o si la gata se pone enferma, debe ser esterilizada. Sólo se utilizan prostaglandinas naturales, ya que aún no se ha establecido una dosis para el uso de prostaglandinas sintéticas con este fin en el gato.
Las gatas se tratan con 0,1 mg/kg de dinoprost (Lutalyse) SC, una o dos veces al día durante 5-7 días.
El objetivo principal de la PGF2 es hacer que el útero se contraiga y expulse su contenido.
Los efectos luteolíticos de la PGF2 observados en otras especies no se han documentado en la gata.
Si el CL felino responde a la PGF2, parece que se necesitan varios días de tratamiento para efectuar la luteolisis.
Las gatas deben ser vigiladas de cerca durante el tratamiento con PGF2 y pueden ser hospitalizadas durante la parte de cada día que sigue a la administración del fármaco.
Las gatas deben ser vigiladas para detectar el aumento de la fiebre, el dolor abdominal u otros síntomas de enfermedad sistémica o la rotura del útero (que podría provocar una peritonitis).
Además de los recuentos sanguíneos, puede ser necesario el control con radiografías o ecografías.
La tasa de complicaciones con este tratamiento es muy baja.
Los efectos secundarios se observan con frecuencia, normalmente a los pocos minutos de la inyección, y empeoran en los dos primeros días.
Los efectos contráctiles de la PGF2 en la musculatura lisa del miometrio, el tracto gastrointestinal, el tracto respiratorio y la vejiga son los responsables de estas reacciones.
Los efectos secundarios incluyen inquietud, vocalización, jadeo, vómitos, diarrea, salivación y un intenso aseo de los flancos y la vulva.
Estos efectos suelen durar sólo unos minutos, raramente más de 15-20 minutos.
Las reacciones se hacen menos evidentes con cada tratamiento. Por lo general, al quinto día, los efectos secundarios son escasos o nulos. Deben administrarse antibióticos durante todo el curso de la terapia con PGF2 y durante algún tiempo después.
El veterinario debe realizar un seguimiento de las gatas una y dos semanas después del tratamiento con PGF2.
El flujo vaginal debe cambiar a un líquido claro al séptimo día después del tratamiento. Este flujo claro puede durar hasta 10 días.
La mayoría de las gatas vuelven a la normalidad dos semanas después del tratamiento.
Si la secreción purulenta o sanguinolenta es persistente, puede ser necesario un segundo tratamiento.
La mayoría de las gatas vuelven a estar en celo en varias semanas y deben ser montadas en la primera oportunidad.
Puede ser valioso tratar a la gata con antibióticos durante este celo y en las primeras 4 semanas de cualquier embarazo resultante.
Debe elegirse un antibiótico seguro para su uso durante la gestación, como la amoxicilina/ácido clavulánico (Clavamox®).
Ocasionalmente, una gata tiene un segundo episodio de piometra después de una preñez, pero repetir el tratamiento con PGF2 puede permitirle tener una camada en el futuro.
Después del tratamiento con PGF2, se han reportado tasas de preñez de 71-86%.
Davidsonet al (1992) informaron de la recurrencia de la piometra en el plazo de 1 año en el 14% de las gatas tratadas.
Algunas gatas (4%) tendrán una peritonitis generalizada subclínica asociada a la piometra, lo que puede contribuir a problemas continuos de mala salud y eventualmente requerir una ovariohisterectomía.
No hay informes sobre el éxito del tratamiento de la piometra cerrada en el gato, aunque en el perro la tasa de éxito es del 34%.
Criptorquidia en Gatos
Susan Little, DVM, DABVP (Felina)
Hospital de gatos de Bytown
Ottawa, Ontario, Canadá
Los informes de casos de criptorquidia en gatos han aparecido ocasionalmente en la literatura veterinaria, pero hay pocos datos detallados de incidencia disponibles sobre la criptorquidia en grandes poblaciones de gatos presentados para la castración. Además, hay pocos datos disponibles sobre la incidencia de la criptorquidia en varias razas con pedigrí.
Se examinaron los registros de 4.140 gatos presentados para su castración en dos hospitales veterinarios especializados en felinos durante un periodo de 10 años y medio (de enero de 1993 a junio de 2003). Setenta y dos gatos (1,7%) fueron identificados como criptórquidos. Esta incidencia es similar a los resultados de otros estudios (rango del 1,3% al 1,9%) de un gran número de gatos, pero es inferior a la notificada en un estudio más pequeño (3,8%). Las tasas de incidencia notificadas en perros en estudios recientes varían del 2,6% al 6,8%.
Tres gatos (< 0,08%) del presente estudio fueron identificados como monórquidos (dos persas/himalayos, uno criado al azar). Este hallazgo es menor que la incidencia de monorquidia identificada en un estudio anterior (0,15%) que incluía un número menor de gatos.
De los 4.140 gatos presentados para la castración, 437 (10,5%) eran gatos de raza, representando 22 razas. La incidencia de criptorquidia en los gatos de raza fue del 6,2%, significativamente mayor que la de los gatos sin raza (1,3%). La incidencia de criptorquidia en los perros con pedigrí también es superior a la de los perros criados al azar. Ocho razas de gatos estaban representadas por 10 o más individuos.
La mayor incidencia de criptorquidia se encontró en la raza Ragdoll (18,75%), aunque sólo se incluyó un pequeño número de gatos Ragdoll (16). En estudios anteriores se había encontrado una incidencia de criptorquidia en la raza persa de hasta el 29%. En el presente estudio, que incluyó un mayor número de gatos persas/himalayos que los informes anteriores, la incidencia en la raza fue del 10,4%.
La localización del testículo o testículos retenidos se conocía en 62 de los 72 gatos criptórquidos. La mayoría de los gatos (88,7%) eran criptórquidos unilaterales. La configuración más común era la criptorquídea unilateral e inguinal (51,6%). Las criptorquidias unilaterales derechas y unilaterales izquierdas estaban representadas de forma similar. Los informes anteriores han mostrado datos contradictorios sobre la localización más común del testículo retenido unilateralmente. En los criptorquidos unilaterales de este informe, el testículo retenido era significativamente más probable que fuera inguinal. Sólo 7 de los 61 gatos (11,3%) eran criptorquidos bilaterales; 2 (3,2%) gatos eran inguinales bilaterales y 5 (8,1%) gatos eran criptorquidos abdominales bilaterales.
En conclusión, éste representa el mayor y más completo estudio sobre criptorquidia en gatos e incluye nuevos datos sobre razas con pedigrí. La criptorquidia en general es menos común en los gatos que en los perros. Las razas de gatos con pedigrí son más propensas a la criptorquidia que los gatos criados al azar y la tasa más alta de criptorquidia se encontró en la raza Ragdoll.
Introducción
Cada testículo comienza en el interior de la cavidad abdominal del gatito y desciende al escroto tras pasar por el canal inguinal en la ingle.
Normalmente, los testículos están presentes en el escroto al nacer o poco después, aunque pueden ser muy pequeños y difíciles de detectar.
A la edad de 6 a 8 semanas, deberían ser lo suficientemente grandes como para ser palpados. Sin embargo, es posible que los testículos no permanezcan en el escroto de forma permanente hasta los 4 ó 6 meses de edad.
Hasta ese momento, los músculos cremáster pueden retraer los testículos inmaduros hacia la ingle.
La criptorquidia se refiere a la incapacidad de uno o ambos testículos para descender al escroto y permanecer allí a los 7 u 8 meses de edad.
Aunque la criptorquidia unilateral es la más común, puede ser bilateral. Se sugiere que el modo de herencia es recesivo y poligénico, y los varones criptorquídicos no deben utilizarse para la cría.
Los machos criptórquidos unilaterales pueden ser fértiles, por lo que deben ser castrados.
¿Es un rasgo hereditario?
La criptorquidia es un ejemplo de rasgo limitado al sexo.
El rasgo se expresa físicamente sólo en el macho, aunque las hembras puedan ser portadoras del mismo.
Tanto el padre como la madre de un gato afectado deben considerarse portadores.
Algunos hermanos completos de un gato afectado también serán portadores. La reducción del número de gatos criptórquidos en un programa de cría puede conseguirse eliminando de la cría a los machos afectados y a los padres portadores.
Si el problema está extendido en una línea familiar, los hermanos completos de un gato afectado también deberían ser eliminados del programa de cría.
Un gato joven con criptorquidia bilateral que muestra la ausencia de testículos pero con espinas en el pene. Las espinas indican que hay una fuente de testosterona presente.
¿Es común?
En los perros, la incidencia de la criptorquidia se ha estimado en un 1,2%.
Por el contrario, un estudio realizado en el Animal Medical Center de Nueva York descubrió que la tasa de criptorquidia en gatos atendidos en esa institución era del 3,8%.
El gato de raza pura más representado en este estudio fue el persa (20% de los casos).
Otras razas representadas fueron el Himalayo (6%) y el Siamés (4%). Los gatos DSH representaban el 50% y los DLH el 6%. La mayoría de las criptorquidias eran unilaterales (90%) y de estos gatos, los lados izquierdo y derecho estaban igualmente afectados.
En los gatos en los que se registró la localización del testículo retenido en la historia clínica, el 49% estaba en la ingle, el 33% estaba en el abdomen y el 14% estaba dentro del anillo inguinal.
Dos gatos de este estudio (2%), un birmano y un abisinio, eran monórquidos (sólo había un testículo). Los cordones y vasos espermáticos estaban presentes, pero terminaban sin testículo.
Otro estudio realizado en la Universidad Estatal de Michigan analizó la incidencia de criptorquidia en gatos durante un periodo de 10 años (1980-1989). Este estudio encontró una incidencia del 1,7%. Dos gatos eran monórquidos (0,1%).
Los persas también estaban sobre representados en este estudio con una incidencia del 29%. La mayoría de las criptorquidias eran unilaterales (78%) también en este estudio. Todos los criptórquidos bilaterales tenían testículos retenidos en el abdomen. Se examinaron los tejidos de los testículos retenidos en el abdomen y no se encontraron espermatozoides.
Es probable que los testículos retenidos en el abdomen sean estériles porque la mayor temperatura en el interior del cuerpo suprime el desarrollo de los espermatozoides.
Sin embargo, los gatos con testículos retenidos situados fuera del abdomen pueden ser fértiles.
El pene de un gato macho castrado no tiene espinas. Éstas desaparecen a las 6 semanas de la castración.
¿Existe un tratamiento recomendado?
No existe ningún tratamiento que haya demostrado que pueda hacer que un testículo retenido descienda al escroto.
El tratamiento con hormonas llamadas gonadotropinas no ha tenido éxito. En otras especies, la extirpación quirúrgica del testículo retenido y la castración se recomiendan de forma rutinaria porque el testículo retenido corre el riesgo de sufrir cáncer o torsión y las pruebas de una causa hereditaria son más definitivas.
La torsión del cordón espermático no se ha documentado en el gato y los tumores testiculares son muy raros en esta especie. Sin embargo, la probabilidad de que la criptorquidia sea hereditaria en el gato es razón suficiente para recomendar la castración y la extirpación del testículo retenido en los gatos de raza pura.
Los gatos criptórquidos a los que se les extirpa sólo el testículo escrotal mostrarán todos los comportamientos normales de un macho intacto. Por lo tanto, es importante que se extirpen ambos testículos cuando el gato se destine a un hogar de mascotas.
Hernia diafragmática felina
Peritoneopericárdica en el gato: Caso clínico
Resumen. Se describe un caso clínico de hernia diafragmática congénitaperitoneo-pericárdica en un gato persa de ocho semanas de edad.
Los signos clínicos más importantes eran la disnea y taquipnea en reposo.
Se auscultaron sonidos cardíacos apagados en ambos lados del tórax y elECG mostraba una taquicardia sinusal. Las radiografías torácicasevidenciaron una silueta cardíaca muy aumentada y de forma redondeada,una fusión del borde caudal cardíaco y el lado ventral del diafragma, y una posición anormal del estómago. La laparotomía abdominal descubrió la
casi total herniación del hígado en saco pericárdico. El defecto se corrigió quirúrgícamenre. Se discute la muerte del animal provocada por neumotórax, secuela de la intervención.
Introducción
Una hernia diafragmática es la protusión de una víscera abdominal en la cavidad torácica a través del diafragma. Pueden ser tanto congénitas como adquiridaso traumáticas. Las congénitas se clasifican en pleuroperitoneales, híatales y peritoneopericárdicas
Las hernias peritoneopericárdicas resultan del desarrollo incompleto del diafragma ventral, originado por el septum transversum embrionario, y de lafusión incompleta de las membranas pleuropericárdicas,lo que provoca una comunicación persistente entre las cavidades peritoneal y pericárdica.
Esta comunicación permite que el contenido abdominal se hernie en el saco pericárdico, permaneciendo el espacio pleural intacto.
Aunque en la mayoría de los pacientes con este defecto los síntomas aparecen antes del primer año de vida (en el gato concretamente, están descritosa partir de los dos meses de edad), algunos animales permanecen clínicamente normales durante años o incluso durante toda la vida.
El cuadro de síntomas varía desde problemas gastrointestinales (vómitos, anorexia, pérdida de peso),a respiratorios (disnea, tos, intolerancia al ejercicio),e incluso nerviosos (convulsiones, cegueras), estos últimos probablemente debidos a una encefalopatía hepática.
En casos crónicos, debido al compromiso del retorno venoso y al taponamiento cardíaco producido por las vísceras abdominales herniadas,pueden aparecer cuadros de insuficiencia cardíaca congestiva, con ascitis, tos, etc.
En la exploración física es frecuente observar taquicardia y taquipnea en reposo, así como abdómenes más pequeños de lo normal, con ausencia a la palpación de las vísceras herniadas. La auscultación de latidos cardíacos apagados y/o desplazados, y la presencia de borborigmos en cavidad torácica, son
los datos más característícos’v-«.Los hallazgos radiográficos consisten en una silueta cardíaca de forma globosa sin evidencia de aumento de ninguna cámara en particular. En la vista lateral se observa una continuación del borde caudal cardíaco con el diafragma ventral, y un desplazamiento dorsal de la tráquea.
Cuando el órgano herniado es el intestino o el estómago, puede aparecer aire en saco pericárdico. Estas vísceras se visualizan mejor administrando una sustancia de contraste,como el sulfato de bario.
Este tipo de hernia diafragmática congénita es poco frecuente en la clínica de pequeños animales importante, sin embargo, reconocer sus aspectos clínicos, protocolo de diagnóstico y tratamiento,ya que la mayoría de ellas tienen un buen pronóstico.
Caso Clínico
Un gato persa, macho, de dos meses de edad, fue presentado a la consulta por dificultad respiratoria de aparición súbita. El gato pertenecía a unos criadores que habían observado un crecimiento pobre del cachorro con respecto al resto de la camada, a pesar de tener un apetito normal.
A la exploración clínica el gato presentaba disnea y taquipnea, con una frecuencia de 120 respiraciones por minuto.
Las mucosas y temperatura corporal eran normales. La auscultación torácica fue dificultosa,debido a la disnea y a que los latidos cardíacos sonaban apagados, en ambos lados del tórax.Se auscultaba una taquicardia y un aumento del murmullo vesicular; no percibiéndose arritmias, soplos o ritmos de galope.
El pulso femoral era fuerte,con una frecuencia de 260 pulsaciones por minuto.
El electrocardiograma, en la derivación II (velocidad de 50 mm/seg y lMv = 1 cm) mostraba una taquicardia sinusal, con una frecuencia cardíaca de 260 latidos por minuto. El resto de los parámetros electrocardiográficos eran normales .
Las radiografías de tórax mostraron una silueta cardíaca redondeada y muy aumentada de tamaño, que ocupaba la mayoría de la cavidad torácica . La porción terminal de la tráquea estaba desplazada dorsalmente, de forma paralela a la columna torácica, al estar comprimida ventrodorsalmente
En la toma lateral, se observaba una fusión del margen externo del corazón y la porción ventral del diafragma, haciéndonos sospechar de Un defecto diafragmático .
Se le administró sulfato de bario, repitiéndose las radiografías a los 15 minutos. Se observaba una posición anormal del estómago, que se encontraba desplazado al lugar de proyección hepática, estando ésta ausente.
Teniendo en cuenta la edad del animal, los problemas de crecimiento, la ausencia en la historia clínica de traumas, los sonidos cardíacos apagados, y los hallazgos radiográficos, diagnosticamos una hernia congénita peritoneopertcárdica.
El estado del animal se fue deteriorando progresivamente (con anorexia, agravamiento de la disnea,etc.), haciéndose necesaria la intervención quirúrgica.
La medicación preanestésica consistió en una mezcla de clorhidrato de ketamina, acepromacina y atropina,manteniendo al animal con anestesia inhalatoria (Fluotane y Oxígeno), mediante circuitO cerrado.
La preparación quirúrgica fue realizada de la forma habitual para este tipo de intervenciones. El animal se colocó en decúbito supino y mediante una ligera elevación del tórax, intentando desplazar caudalmente las vísceras abdominales del diafragma. Durante toda la intervención le fue administrada una solución de Ringer lactato por vía parenteral.
La incisión por línea media abdominal ventral, desde cartílago xifoides a ombligo, reveló un defecto de unos tres centímetros de longitud, en la porciónventral media del diafragma, siendo muy escasa la porción muscular izquierda
Observamos la casi íntegra presencia del hígado en saco pericárdico. Solo parte del lóbulo ventral permanecía en el abdomen y con una localización anormal
La reposición del hígado a su situación original nos fue dificultada por la presencia de múltiples adherencias,por lo que fue necesario ampliar la incisión inicial mediante esternotornía y además realizar una apertura total del defecto diafragmático. Se trataba de un hígado muy congestivo por lo que su manejo tuvo que ser muy cuidadoso.
Una vez situado en cavidad abdominal se procedió al cierre del diafragma. Esta sutura resultó muy complicada debido a la extensión del defecto muscular izquierdo, teniendo que cerrar, suturando la porción del diafragma existente a la pared abdominal izquierda, mediante puntos sueltos con material reabsorbible
Aunque durante toda la intervención el animal se mantuvo sin respiración asistida, antes de realizar el cierre de la última sutura se procedió al llenado total de los pulmones, creando una presión positiva,con el fin de evitar un neumotórax. El cierre de la
cavidad abdominal se realizó de forma rutinaria, con sutura discontinua de material no reabsorbible
La radiografía posterior a la intervención mostró un neumotórax severo, una posición anormal de la silueta cardíaca y un edema en el lóbulo diafragmático pulmonar
El gato murió transcurrida aproximadamente una hora de la intervención.
DISCUSIÓN
Las malformaciones congénitas en el pericardioson un hallazgo muy poco frecuente en medicina felina,siendo éste el primer caso descrito en España.
Se han realizado estudios para determinar si esta clase de hernia es hereditaria’?’. En el caso que describimos,el cachorro pertenecía a unos criadores de gatos persas, que habían cruzado los mismos progenitores en numerosas ocasiones y nunca habían tenido este problema. El resto de la camada era normal.
Aunque nosotros no lo hemos observado, otros autores describen la coexistencia de este defecto pericárdico con otras anormalidades como la fusión,ausencia o malformación de esternebras, hernias umbilicales y anormalidades en la pared ventral abdominal El cuadro clínico y los datos de la exploración física son muy inespecíficos, pudiendo sugerirnos otro
tipo de alteraciones como hernias pleuroperitoneales, enfermedades respiratorias, malformaciones cardíacas congénitas, insuficiencia cardíaca congestiva,obstrucción intestinal, y defectos congénitos esofágicos o gastrointestinales. El diagnóstico definitivo,por lo tanto, debe realizarse con la ayuda de otros medios, como la electrocardiografía y fundamentalmente el examen radiológico.
En el perro, la disminución en el voltaje de los complejos QRS es el hallazgo electrocardiográfico más característico de taponamiento cardíacoCz-4.6,B).
Nos parece, sin embargo, que la amplitud normalmente baja de los complejos QRS en el gato, hace que esta disminución sea un dato de difícil apreciación. El ritmo cardíaco consiste generalmente en una taquicardia sínusal'».
Un dato importante para el diagnóstico diferencial con las malformaciones congénita,cardíacas y la insuficiencia cardíaca congestiva,es que es muy poco frecuente la aparición de otras arritmias y el resto de los parámetros electrocardiográficos suelen ser normales.
El examen radiográfico nos parece el procedimiento más significativo para el diagnóstico de una hernia peritoneopericárdica. Si es posible, deben tomarse placas, tanto laterales como dorsoventrales. La vista dorsoventral en un animal con sospecha de hernia diafragmática, que tiene comprometida la función respiratoria, es más segura que la posición ventrodorsal.
Cuando el órgano herniado es una víscera como el hígado o el bazo, el diagnóstico puede resultar más complicado, teniendo que recurrir a otras técnicas como el neumoperitoneograma, la hepatografía intravenosa, o la angiografía de la arteria mesentérica.
En el caso que describimos, no nos pareció necesario realizarlas, ya que unido a las anomalías radiográficas previamente descritas, observamos la ausencia de la silueta hepática, con un desplazamiento del estómago a la zona ventral del diafragma, haciéndonos sospechar que la hernia estaba constituida, al menos en parte, de hígado en saco pericárdico.
Se han descrito tres abordajes diferentes para la resolución de las hernias diafragmáticas: 1) Toracotomía lateral, 2) Abordaje transtorácico, 3) Laparotomía por línea media, pudiendo ser ampliada por esternotomía medía'».
La toracotomía lateral se aconseja como vía de acceso por permitir una buena visualización de las adherencias existentes y su fácil desinserción.
Por otra parte, las adherencias son poco frecuente y el uso de este abordaje obliga a concretar la localización lateral de la hernia, ya que un fallo de diagnóstico o una hernia bilateral implicaría la necesidad de extender la incisión mediante un abordaje transtorácico a través del esternón o realizar una segunda toracotornía lateral en el lado contrarío.
El abordaje transtorácico no se describe, sin embargo, como método de elección por su carácter cruento.
La laparotomía por línea media abdominal es aconsejada por ser muy sencilla de realizar y causar menor dolor postoperatorio que la toracotomía, aunque tiene como desventajas el acceso al diafragma por su superficie cóncava, haciendo más difícil la desinserción de adherencias, en el caso de existir, así como la interferencia de las vísceras abdominales en la visualización del defecto.
En el caso clínico presentado, se realizó una laparotomía media abdominal, teniendo que ser ampliada por esternotomía al comprobar que la víscera herniada era el hígado y que su reposición a cavidad abdominal resultaba dificultosa por el grado de congestión hepática y las adherencias existentes, consiguiendo de esta forma, un buen acceso quirúrgico.
Una vez eliminadas las adherencias y situado el hígado en cavidad abdominal, se comprobó que la porción izquierda del diafragma era casi inexistente.
El defecto quedó resuelto al suturar el diafragma a la pared abdominal izquierda.
La comprobación radiológica postoperatoria reveló la existencia de un neumotórax, edema en el lóbulo diafragmático pulmonar, así como una posición anormal de la silueta cardíaca. Estos hallazgos nos hicieron sospechar que el cierre diafragmático no había sido completo, quedando el espacio pleural comprometido, y que la desituación cardíaca se provocó al realizar una tracción excesiva del diafragma al suturarlo a la pared abdominal izquierda.
Para evitar complicaciones de este tipo, otros autores describen la utilización de injertos autógenos, homólogos o sintéticos. Una malla de teflón, una lámina del tensor de la fascia lata del muslo, un injerto deslizante de la pared abdominal lateral o un trozo de omento, han sido descritos para completar el cierre de defectos diafragmáticos de gran tamaño.
El omento es el material más accesible y al ser autógeno evita cualquier problema de rechazo. A pesar de esto, la técnica es complicada y no ha sido publicada su utilización clínica en perro y gato. El riesgo de neumotórax podrá ser también reducido mediante el uso de un drenaje torácico previamente insertado o por toracocentesis.
También por combinación de ambas. Se considera el método de elección la inserción de un drenaje tipo Pen-Rose,ya que aporta la ventaja de reducir el posible edema pulmonar producido al inflar excesivamente los pulmones durante el cierre de la cavidad torácica.
Por último, debemos resaltar que, en nuestra opinión, el pronóstico de este tipo de hernias depende de varios factores:
– Cronicidad de la hernia.
– Tamaño del defecto y su localización.
– Los órganos herniados.
– Viabilidad de dichos órganos,y la presencia o ausencia de adherencias.
Revista de AVEPA. Vol. 7, N° 4-1987
© 2021 Berkano Cattery – Todos los derechos reservados.Todo el material de este sitio está protegido por derechos de autor y no puede ser impreso o reproducido, en ninguna forma, sin el consentimiento expreso por escrito del Criadero Berkano.
Página desarrollada con ❤ por Cattery Web.
